ジェネリックの品質や安全性は?
厚生労働省の品質基準をクリアしています
新薬と同等の「効き目」や「安全性」であることを厳しくチェックしています。

日本で医療用医薬品を認可しているのは、厚生労働省です。もちろんジェネリック医薬品も、その管理・指導のもとに開発されています。
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」によって細かな基準が定められており、生物学的同等性試験、安定性試験などをクリアしたものだけが製品化を許可されています。
開発段階でのさまざまな試験
-
新薬の場合
きちんと作用している
-
ジェネリック医薬品の場合
新薬と同じように作用することを厚生労働省がチェック
<試験例>
- ●生物学的同等性試験ジェネリック医薬品の血中濃度が先発医薬品と同じように推移するかどうかを確かめる試験
- ●安定性試験有効期間内の品質を保証するための試験
- ●溶出試験水やpHの異なるさまざまな溶液での溶け方を比べる試験
ジェネリック医薬品と新薬の
有効性・安全性は同等です
ジェネリック医薬品と新薬とは、有効性や安全性について基本的に違いはありません。ジェネリック医薬品は、先発医薬品と異なる添加剤を使用する場合がありますが、先発医薬品が発売後に添加剤を変更する場合と同様に、添加剤の違いによって有効性・安全性に違いが生じないことを確認しています。
医薬品を適正に使用したにもかかわらず、重篤な副作用が発生してしまった場合は、新薬と同様に「医薬品副作用被害救済制度」という公的な制度が適用されます。お薬の副作用に関しては、新薬・ジェネリック医薬品にかかわらず、お医者さん・薬剤師さんに必ずご相談ください。
独立行政法人 医薬品医療機器総合機構 「医薬品副作用被害救済制度」サイトはこちら
独立行政法人 医薬品医療機器総合機構 「患者の皆様からの医薬品副作用報告」サイトはこちら
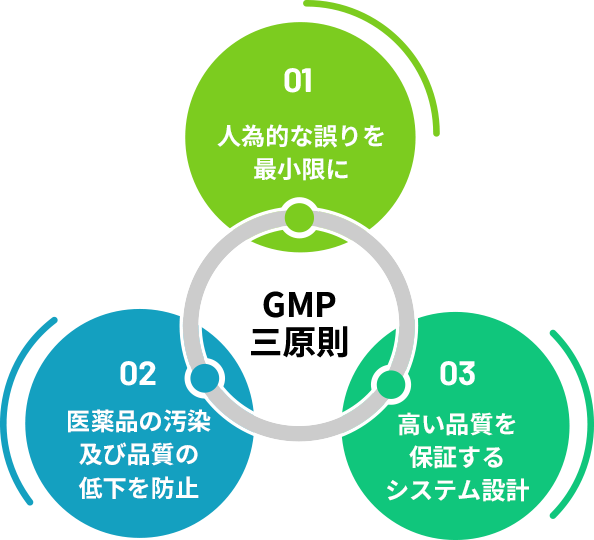
GMP三原則を遵守した品質管理
医薬品の製造には、国の定めたGMP(※)と呼ばれる基準による厳しい品質管理が行われます。
GMPには三つの原則があり「①人為的な誤りを最小限にすること」「②医薬品の汚染及び品質の低下を防止すること」「③高い品質を保証するシステムを設計すること」が定められています。
※GMP(Good Manufacturing Practice)医薬品製造における厳しい製造管理、品質管理に関する基準のこと。
東和薬品の品質と安全性の取り組みについてはこちら